Фирмагон
Склад
діюча речовина: дегарелікс;
1 флакон містить дегареліксу (у вигляді ацетату) 120 мг або 80 мг,
після розчинення концентрація становить 40 мг/мл або 20 мг/мл;
допоміжні речовини: маніт (Е 421);
1 попередньо наповнений шприц з розчинником містить 4,2 мл або 3,0 мл води для ін'єкцій.
Лікарська форма
Порошок для розчину для ін'єкцій.Основні фізико-хімічні властивості:
порошок: білий або майже білий ліофілізат у вигляді коржа;
розчинник: прозора, безбарвна рідина.
Фармакотерапевтична група
Антагоністи гормонів та аналогічні засоби.Код ATХ L02B X02.
Фармакологічні властивості
Фармакодинаміка.
Дегарелікс – селективний антагоніст гонадотропін-рилізинг-гормону, що конкурентно й оборотно зв'язується з рецепторами гіпофізарного гонадотропін-рилізинг-гормону (ГнРГ), швидко знижуючи вивільнення гонадотропінів, лютеїнізуючого гормону (ЛГ) та фолікулостимулюючого гормону (ФСГ), і, таким чином, індукує секрецію тестостерону яєчками. Карцинома простати є андрогенчутливою та відповідає на лікування, яке видаляє джерело андрогенів. На відміну від агоністів ГнРГ, блокатори гонадотропін-рилізинг-гормону не індукують викид ЛГ з подальшим викидом тестостерону/стимуляцією росту пухлини, потенційним загостренням симптомів після початку терапії.
Одноразове введення 240 мг Фірмагону, після якого вводять щомісячну підтримуючу дозу
80 мг, швидко знижує рівень ЛГ, ФСГ і, отже, тестостерону. Концентрація дигідротестостерону (ДГТ) в плазмі знижується так, як і концентрація тестостерону.
Фірмагон ефективний щодо досягнення і підтримання пригнічення секреції тестостерону нижче рівня медичної кастрації 0,5 нг/мл. Підтримуюча доза 80 мг на місяць призводить до стійкого пригнічення секреції тестостерону у 97 % пацієнтів щонайменше протягом року.
Мікроколивань тестостерону після повторної ін'єкції в ході лікування Фірмагоном не спостерігалося. Середній рівень тестостерону після одного року лікування становив
0,087 нг/мл (інтерквартильний інтервал 0,06-0,15), N=167.
Результати підтверджуючого дослідження фази ІІІ
Ефективність і безпеку дегареліксу оцінювали в ході відкритого багатоцентрового рандомізованого дослідження на паралельних групах із застосуванням активного препарату контролю. В ході дослідження вивчали ефективність і безпеку двох різних місячних режимів дозування дегареліксу із початковою дозою 240 мг (40 мг/мл) та подальшим підшкірним введенням місячних доз 160 мг (40 мг/мл) або 80 мг (20 мг/мл) порівняно з місячним внутрішньом'язовим введенням 7,5 мг лейпрореліну пацієнтам із раком передміхурової залози, що потребує антиандрогенної терапії. Усього 620 пацієнтів було рандомізовано в одну з трьох груп лікування, з них 504 (81 %) завершили дослідження. У групі лікування дегареліксом 240/80 мг 41 (20 %) пацієнт вибув із дослідження порівняно з 32 (16 %) у групі, що отримувала лейпрорелін.
Із 610 пацієнтів, які проходили лікування:
· 31 % мали локалізований рак передміхурової залози;
· 29 % мали місцевопоширений рак передміхурової залози;
· 20 % мали рак передміхурової залози з метастазами;
· 7 % мали невизначений метастатичний статус;
· 13 % мали в анамнезі операцію або променеву терапію, спрямовану на вилікування, та наявне підвищення рівня простатичного специфічного антигену (ПСА).
Вихідні персональні дані були аналогічними в усіх групах. Середній вік становив 74 роки (діапазон від 47 до 98 років). Основною метою було продемонструвати ефективність дегареліксу щодо досягнення та підтримання супресії тестостерону на рівні, нижчому за 0,5 нг/мл, протягом 12 місяців лікування.
Було обрано найнижчу ефективну підтримуючу дозу дегареліксу 80 мг.
Досягнення рівня тестостерону в сироватці крові (T)≤0,5 нг/мл
Фірмагон ефективний для досягнення швидкої супресії тестостерону, див. таблицю 1.
Таблиця 1
Відсоток пацієнтів, які досягли рівня T≤0,5 нг/мл після початку лікування.
Уникнення коливань тестостерону
Коливання було визначено як рівень тестостерону, що перевищує вихідний на ≥15 % протягом перших 2 тижнів.
У жодного з пацієнтів, які отримували лікування дегареліксом, не було коливань тестостерону; спостерігалося середнє зниження рівня тестостерону на 94 % на 3-й день. У більшості пацієнтів, які отримували лікування лейпрореліном, було коливання тестостерону; спостерігалося середнє підвищення рівня тестостерону на 65 % на 3-й день. Ця різниця була статистично значущою (p
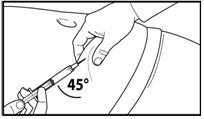
7. Зробіть глибоку підшкірну ін'єкцію.
Для цього зберіть шкіру живота у складку, злегка підніміть підшкірну тканину і введіть голку глибоко під кутом не менше 45 градусів.
Введіть повільно 4 мл Фірмагону 80 мг одразу після розведення.
8. Не слід робити ін'єкції в місцях, які будуть піддаватися тиску, наприклад у ділянку під ременем або поясом або близько до ребер.
Не вводьте безпосередньо у вену. Обережно потягніть поршень на себе, щоб переконатися у відсутності крові у шприці. При появі крові препарат не можна застосовувати далі. Припиніть процедуру та видаліть шприц з голкою і препаратом (розведіть нову дозу для пацієнта).
Після розчинення препарат слід негайно ввести. Хімічна і фізична стабільність розведеного розчину зберігається протягом 2 годин після розведення.
Діти
Препарат не застосовують дітям.Передозування
Клінічний досвід щодо наслідків гострого передозування Фірмагону відсутній.
У кожному випадку передозування за пацієнтом слід встановити спостереження, а за необхідності – проводити підтримуючу терапію.
Побічні реакції
Побічні реакції, що найбільш часто спостерігалися під час терапії дегареліксом у ході підтверджуючого дослідження фази III (N = 409), були або пов'язані з очікуваними фізіологічними ефектами пригнічення секреції тестостерону, у тому числі з припливами та збільшенням маси тіла (виявлено відповідно у 25 % і 7 % пацієнтів, які отримували лікування протягом одного року), або були побічними ефектами в місці ін'єкції. Транзиторний озноб, гарячка або грипоподібний стан були зареєстровані протягом кількох годин після прийому препарату (в 3 %, 2 % і 1 % пацієнтів відповідно).
Побічні реакції в місці ін'єкції, які в основному проявлялися болем та еритемою, виявлені у 28 % і 17 % пацієнтів відповідно, менш частими були набряки (6 %), індурація (4 %) та утворення вузликів (3 %). Ці події спостерігалися найчастіше на тлі стартової дози, тоді як під час проведення підтримуючої терапії дозою 80 мг частота цих подій на 100 ін'єкцій становила 3 для болю і
Побічні ефекти розподілені за системами органів та частотою виникнення: дуже поширені (≥1/10); поширені (≥1/100 до
Частота побічних реакцій, про які повідомлялося у 1259 пацієнтів, які проходили лікування, із загальної кількості 1781 пацієнто-років (дослідження фаз ІІ і ІІІ) та з постмаркетингового дослідження.
Розлади з боку кровіі лімфатичноїсистеми. Поширені: анемія*. Рідкісні: нейтропенічна гарячка.
Розлади з бокуімунної системи. Непоширені: гіперчутливість. Рідкісні: анафілактичні реакції.
Розлади метаболізму. Поширені: збільшення маси тіла*. Непоширені: гіперглікемія/ цукровий діабет, підвищення рівня холестерину, зниження маси тіла, зниження апетиту, зміна рівня кальцію в крові.
Розлади з боку нервової системи. Поширені: запаморочення, головний біль, безсоння. Непоширені: гіпестезія, психічні порушення, депресія, зниження лібідо*.
Розлади з боку органів зору. Непоширені: зниження гостроти зору.
Розлади з боку серця. Непоширені: серцеві аритмії (у тому числі фібриляція передсердь), серцебиття, подовження інтервалу QT*. Рідкісні: інфаркт міокарда, серцева недостатність.
Порушення з боку судин. Дуже поширені: припливи*. Непоширені:артеріальна гіпертензія, вазовагальна реакція (включаючи гіпотензію).
Розлади з боку дихальної системи та органів грудної клітки. Непоширені: диспное.
Розлади з бокушлунково-кишкового тракту. Поширені: нудота, діарея. Непоширені: запор, блювання, дискомфорт у ділянці живота, абдомінальний біль, сухість у роті.
Розлади з боку гепатобіліарної системи. Поширені: підвищення рівня печінкових трансаміназ. Непоширені: підвищення рівня білірубіну, підвищення рівня лужної фосфатази.
Розлади з боку шкіри і підшкірної клітковини. Поширені: гіпергідроз (у тому числі нічна пітливість)*, висипання. Непоширені: кропив'янка, свербіж, вузликове висипання, алопеція, еритема.
Розлади з боку кістково-м'язової системи та сполучної тканини. Поширені: кістково-м'язовий біль та дискомфорт. Непоширені: остеопороз/остеопенія, артралгія, м'язова слабкість, м'язові спазми, набряк/скутість суглобів.
Розлади з боку сечовидільної системи. Непоширені: полакіурія, невідкладний позив до сечовипускання, дизурія, ніктурія, ниркова недостатність, нетримання сечі.
Розлади з боку репродуктивної системи і молочних залоз. Поширені: еректильна дисфункція*, атрофія яєчок*, гінекомастія*. Непоширені: тазовий біль, тестикулярний біль, біль у грудях, подразнення в ділянці статевих органів, порушення еякуляції.
Загальні розлади та реакції в місці введення. Дуже поширені: реакції у місці ін'єкції. Поширені: озноб, гарячка, підвищена втомлюваність*, грипоподібний стан. Непоширені: периферичний набряк, нездужання.
*Фізіологічні наслідки пригнічення секреції тестостерону.
За даними постмаркетингового періоду були рідкісні повідомлення про реакції гіперчутливості, включаючи анафілаксію, кропивКјянку та ангіоневротичний набряк.
Зміни лабораторних показників.
Зміни лабораторних показників розглядалися протягом одного року лікування в підтверджуючому дослідженні фази III (N = 409) і були в тому ж діапазоні як для дегареліксу так і для ГнРГ-агоніста лейпрореліну, який був використаний як препарат порівняння. Суттєве зростання (в 3 рази вище верхньої межі норми) печінкових трансаміназ (АЛТ, АСТ і ГГТ) на тлі лікування обома препаратами було помічено в 2-6 % пацієнтів з нормальними значеннями до лікування. Суттєве зменшення значення гематологічних показників – гематокриту (≤0,37) і гемоглобіну (≤115 г/л) – було відмічено відповідно в 40 % і 13-15 % пацієнтів з початково нормальними показниками. Поки невідомо, якою мірою це зменшення значення гематологічних показників було обумовлено наявністю раку простати і якою мірою це було наслідком андрогенної блокади. Відхилення від норми рівня калію (≥ 5,8 ммоль/л), креатиніну (≥ 177 мкмоль/л) та сечовини (≥ 10,7 ммоль/л) у пацієнтів з нормальними значеннями до початку лікування було відмічено в 6 %, 2 % і 15 % пацієнтів, які отримували дегарелікс, та 3 %, 2 % і 14 % пацієнтів, які отримували лейпрорелін, відповідно.
Зміни ЕКГ.
Зміни ЕКГ, які спостерігали протягом одного року лікування в підтверджуючому дослідженні фази III (N = 409), були в тому ж діапазоні як для дегареліксу, так і для ГнРГ-агоніста лейпрореліну, який використовували як препарат порівняння. У трьох (
Відсутність впливу власне дегареліксу на серцеву реполяризацію (QTcF), частоту серцевих скорочень, АВ-провідність, серцеву деполяризацію або ж морфологію T- або U-хвиль було підтверджено в ході ретельного QT-дослідження у здорових добровольців (N=80), які отримували внутрішньовенну інфузію дегареліксу протягом 60 хв, із досягненням середнього значення Cmax 222 нг/мл, що приблизно у 3-4 рази більше за значення Cmax, отримане при лікуванні раку передміхурової залози.
Термін придатності
3 роки.Не застосовувати після закінчення терміну придатності, зазначеного на упаковці.
Умови зберігання
Зберігати в оригінальній упаковці при температурі не вище 25 °С. Не заморожувати. Зберігати в недоступному для дітей місці.Несумісність
Через відсутність досліджень сумісності цей препарат не слід змішувати з іншими препаратами.
Упаковка
1 флакон з порошком по 80 мг у комплекті з 1 попередньо наповненим шприцом з розчинником по 5 мл (з маркуванням 4,0 мл та об'ємом наповнення 4,2 мл), 1 адаптером для флакона, 1 голкою для введення та 1 стержнем поршня в картонній упаковці.2 флакони з порошком по 120 мг у комплекті з 2 попередньо наповненими шприцами з розчинником по 5 мл (з маркуванням 3,0 мл та об'ємом наповнення 3,0 мл), 2 адаптерами для флакона, 2 голками для введення та 2 стержнями поршня в картонній упаковці.
Категорія відпуску
За рецептом.Виробник
Феррінг ГмбХ, Німеччина/Ferring GmbH, Germany.
Місцезнаходження
Вітланд 11, Постфаш 21 45, Д-24109 Кіль, Німеччина/Wittland 11, Postfach 21 45, D-24109 Kiel, Germany.




