ФАНДИ® 25 МО/мл Комплекс факторів VIII коагуляції крові людини та фон Віллебранда
Склад
1 флакон містить:
|
Фанди® |
25 МО/мл |
50 МО/мл |
100 МО/мл |
|
|
діючі речовини: фактор VIII коагуляції крові людини фактор фон Віллебранда Активність |
250 МО 300 МО |
500 МО 600 МО |
1000 МО 1200 МО |
1500 МО 1800 МО |
|
(загальний білок |
≤ 90 мг |
≤ 90 мг |
≤ 90 мг |
≤ 135 мг) |
|
допоміжні речовини: |
гістидин, альбумін людини, аргінін; |
|||
|
розчинник: вода для ін’єкцій |
10 мл |
10 мл |
10 мл |
15 мл |
Після відновлення лікарський засіб Фанди®містить:
Фанди® 25 МО/мл: 25 МО фактора VIII коагуляції крові людини і 30 МО фактора фон Віллебранда в 1 мл.
Фанди® 50 МО/мл: 50 МО фактора VIII коагуляції крові людини і 60 МО фактора фон Віллебранда в 1 мл.
Фанди® 100 МО/мл: 100 МО фактора VIII коагуляції крові людини і 120 МО фактора фон Віллебранда в 1 мл.
Лікарська форма
Порошок та розчинник для розчину для ін’єкцій.
Основні фізико-хімічні властивості: порошок: білий або блідо-жовтого кольору гігроскопічний порошок або пухка речовина; розчинник: прозора безбарвна рідина.
Фармакотерапевтична група
Фактор фон Віллебранда в комбінації із фактором VIII коагуляції крові.
Код АТХ: В02ВD06.
Фармакологічні властивості
Фармакодинаміка.
У лікарському засобі Фанди® фактор VIII наявний як комплекс у поєднанні з фактором фон Віллебранда.
Комплекс факторів VIII/ фон Віллебранда складається з двох молекул (фактор VIII і фактор фон Віллебранда), що мають різні фізіологічні функції.
Дефіцит фактору VIII
При введенні пацієнту, хворому на гемофілію, фактор VIII зв’язується з фактором фон Віллебранда в крові пацієнта.
Активований фактор VIII діє як кофактор для активованого фактору IX, прискорюючи перетворення фактору X в активований фактор X. Активований фактор X перетворює протромбін на тромбін. Потім тромбін перетворює фібриноген на фібрин і може утворитися згусток.
Гемофілія A є спадковим, пов’язаним зі статтю порушенням згортання крові внаслідок зниженого рівня фактору FVIII, і призводить до значної кровотечі в суглоби, м’язи або внутрішні органи спонтанно або в результаті випадкової або хірургічної травми. За допомогою сумісної терапії рівень фактору FVIII в плазмі крові підвищується, тим самим тимчасово корегуючи дефіцит фактору і підвищену кровотечу.
Хвороба Віллебранда
Дія лікарського засобу Фанди® є ідентичною дії ендогенного фактору фон Віллебранда.
Введення фактору фон Віллебранда дозволяє виправити гемостатичні порушення, які проявляються у пацієнтів з дефіцитом фактору фон Віллебранда (хвороба Віллебранда) на двох рівнях:
- фактор фон Віллебранда відновлює адгезію тромбоцитів до судинного субендотелію у місці пошкодження судини (оскільки він приєднується як до судинного субендотелію, так і до мембрани тромбоциту), забезпечуючи первинний гемостаз, який проявляється у скороченні часу згортання крові. Це виникає негайно і, як відомо, більшою мірою залежить від рівня полімеризації білка;
- фактор фон Віллебранда повільно усуває дефіцит зв’язаного фактору VIII. При внутрішньовенному введенні фактор фон Віллебранда зв’язується з ендогенним фактором VIII (який виробляється у пацієнта), і шляхом стабілізації цього фактору дозволяє запобігти його швидкому руйнуванню.
При введенні препарату фактору FVIII:C, у якому міститься фактор фон Віллебранда, рівень фактору FVIII:C відновлюється одразу після першої інфузії.
Фармакокінетика.
Активність фактору VIII в плазмі крові знижується експоненційно в дві фази.
Напівперіод фактору коагуляції крові людини VII, отриманий в клінічному дослідженні із застосуванням лікарського засобу Фанди®, становить 14,18 ± 2,55 годин і ступінь відновлення активності in vivo становить 105,5 ± 18,5%, що еквівалентно приблизно 2,1 ± 0,4 МО/дл на МО/кг маси тіла для введеного фактору (визначення здійснювалися за допомогою хромогенного методу). Потім визначалися показники MRT 20,6 ± 4,8 h, AUC 19,3 ± 3,7 МО год/мл і період виведення 2,6 ± 0,5 мл/год/кг маси тіла.
Напівперіод фактору коагуляції крові людини VIII і фактору фон Віллебранда, отриманий в клінічному дослідженні із застосуванням лікарського засобу Фанди® у пацієнтів із хворобою Віллебранда, становить 14,4 ± 10,5 годин для фактору фон Віллебранда і 33,4 ± 16,4 годин для фактору VIII, а ступінь відновлення активності in vivo 1,9 ± 0,6 МО/дл на МО/кг ваги тіла введеного для фактору фон Віллебранда і 2,6 ± 0,6 МО/дл на МО/кг ваги тіла введеного для фактору FVIII. Фактор фон Віллебранда визначався як рістоцетин-кофакторна активність і фактор VIII визначався як фактор VIII:C за допомогою хромогенного методу. Далі представлені наступні показники: AUC для vWF:RCo 15,29 ± 10,03; AUC для FVIII:C 49,41 ± 37,74 МО год/мл; період виведення vWF:RCo 5,6 ± 3,3 і FVIII:C 1,4 ± 1,1 мл/год/кг маси тіла.
Максимальні рівні фактору фон Віллебранда в плазмі крові зазвичай досягаються протягом 30 хвилин після введення.
Фактор коагуляції крові людини VIII і фактор фон Віллебранда (діючі інгредієнти лікарського засобу Фанди®) є звичайними складовими плазми крові людини і діють як відповідні ендогенні білки. Тест на токсичність одноразової дози не має значення, оскільки більш високі дози призведуть до перенавантаження.
Повторний тест на токсичність на тваринах неможливий внаслідок взаємодії з антитілами, що виробляються до гетерологічного білку.
Клінічні характеристики
Показання
Лікарський засіб Фанди® призначений для лікування і профілактики кровотечі у пацієнтів з гемофілією A (вроджений дефіцит фактору коагуляції крові VIII).
Лікарський засіб Фанди® призначений для профілактики і лікування кровотечі у пацієнтів з хворобою Віллебранда (vWD), коли лікування лише десмопресином (DDAVP) неефективне або протипоказане.
Цей лікарський засіб можна використовувати для лікування набутого дефіциту фактору VIII. Протипоказання.Гіперчутливість до діючих речовин або будь-якої із допоміжних речовин.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Не відзначалося будь-якої взаємодії між комплексом факторів FVIII/vWF та іншими лікарськими засобами.
Особливості застосування
Як і у випадку з білковими лікарськими засобами для внутрішньовенного введення, можливі реакції гіперчутливості алергічного типу. Окрім білків фактору VIII в лікарському засобі присутні залишки інших білків людини. Пацієнтам слід повідомити про ранні ознаки реакцій гіперчутливості, включаючи алергічний висип, генералізовану кропивницю, ускладнене дихання, свистяче дихання, зниження тиску і анафілактичну реакцію. У разі появи цих симптомів їм може бути рекомендовано негайно припинити використання лікарського засобу і звернутися до лікаря.
У разі виникнення шоку слід дотримуватися діючих медичних стандартів щодо лікування шокового стану.
Стандартні заходи із запобігання інфікуванню при використанні лікарських засобів, вироблених із крові або плазми крові людини, включають вибір донорів, скринінг окремих заборів крові і банків плазми крові на наявність спеціальних маркерів інфікування і включення ефективних етапів виробництва для інактивації/видалення вірусів. Незважаючи на ці заходи, при введенні лікарських засобів, вироблених із крові або плазми крові людини, неможливо повністю виключити можливість передачі інфекції. Це також стосується будь-яких невідомих вірусів і вірусів, що з’являються, а також інших патогенних організмів. Вжиті заходи вважаються ефективними для оболонкових вірусів, наприклад, вірус імунодефіциту людини (HIV), вірус гепатиту B (HBV) і вірус гепатиту C (HCV), а також для безоболонкового вірусу гепатиту А. Здійснені заходи можуть мати обмежену дію щодо безоболонкових вірусів, наприклад, парвовірусу B19. Інфікування парвовірусом B19 може бути небезпечним для вагітних жінок (внутрішньоутробне інфікування) і для осіб з імунодефіцитом або підвищеним еритропоезом (наприклад, гемолітична анемія).
Утворення антитіл (інгібіторів), які нейтралізують фактор VIII, є відомим ускладненням при лікуванні осіб з гемофілією A. Ці інгібітори, зазвичай, є IgG імуноглобулінами, направленими проти прокоагулюючої активності фактору VIII, які кількісно визначаються в Бетезда Одиницях (БО) на мл плазми крові за допомогою методу в Неймегенській модифікації. Ризик утворення інгібіторів корельований з експозицією ангтигемофільного фактору VIII, при цьому найвищий рівень ризику має місце протягом перших 20 днів експозиції. В рідких випадках інгібітори можуть утворюватися по закінченні перших 100 днів експозиції. Пацієнти, які проходять лікування фактором коагуляції крові людини VIII, повинні знаходитися під ретельним наглядом на предмет утворення інгібіторів з використанням відповідних клінічних спостережень і лабораторних тестів. Див. також розділ «Побічні реакції».
При використанні цього лікарського засобу пацієнтами із хворобою Віллебранда існує ризик виникнення тромботичних подій, зокрема, у пацієнтів з відомими клінічними або лабораторними факторами ризику. Тому за пацієнтами, що знаходяться в групі ризику, слід ретельно спостерігати на наявність ранніх ознак тромбозу. Необхідно розпочати профілактику венозної тромбоемболії згідно з діючими рекомендаціями.
При використанні лікарського засобу фактору фон Віллебранда з вмістом фактору FVIII лікар повинен знати, що тривале лікування може призвести до значного підвищення рівня фактору FVIII:С. У пацієнтів, які приймали препарати фактору фон Віллебранда з вмістом фактору VIII, слід контролювати рівень FVIII:C, щоб запобігти тривалому підвищенню рівня фактору FVIII:C у плазмі крові, який може збільшити ризик виникнення тромботичних подій.
У пацієнтів із хворобою Віллебранда, особливо 3-го типу, можуть утворюватися антитіла (інгібітори), які нейтралізують дію фактору фон Віллебранда. Якщо не вдалося досягнути очікуваного рівня активності фактору vWF:RCo у плазмі крові або у разі відсутності контролю над кровотечею на фоні застосування лікарського засобу у рекомендованих дозах, слід провести відповідний аналіз для визначення присутності інгібіторів фактору фон Віллебранда. У пацієнтів з високою концентрацією інгібіторів лікування фактором фон Віллебранда може бути неефективним, і в цьому випадку слід розглянути застосування інших методів лікування.
Щодо пацієнтів, які регулярно/повторно отримують препарати фактору коагуляції крові людини VIII, отриманого з плазми крові, слід розглянути можливість відповідної вакцинації (гепатит A і B).
Наполегливо рекомендується записувати назву і номер серії лікарського засобу при кожному введенні лікарського засобу Фанди® пацієнту, щоб зберегти зв’язок між пацієнтом і серією лікарського засобу.
Застосування у період вагітності або годування груддю.
Дослідження репродуктивної функції у тварин із застосуванням комплексу факторів FVIII/ vWF не проводилися.
Внаслідок того, що у жінок гемофілія А трапляється рідко, досвід застосування комплексу факторів FVIII/ vWF в період вагітності та лактації відсутній.
У зв’язку з цим комплекс факторів FVIII/vWF слід призначати при вагітності і в період лактації лише за наявності явних показань щодо його застосування.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Лікарський засіб Фанди® не впливає або несуттєво впливає на здатність керувати транспортними засобами і іншими механізмами.
Спосіб застосування та дози
Лікування слід розпочинати під наглядом лікаря, який має досвід лікування порушень гемостазу.
Дефіцит фактору VIII
Доза і тривалість замісної терапії залежать від ступеня дефіциту фактору VIII, локалізації і тяжкості кровотечі, а також клінічного стану пацієнта.
Кількість одиниць введеного фактору VIII виражається в Міжнародних Одиницях (МО), які пов’язані з діючим стандартом ВООЗ для препаратів фактору VIII. Активність фактору VIII в плазмі крові виражається або у відсотках (у порівнянні з нормальною людською плазмою крові), або Міжнародних Одиницях (у порівнянні з Міжнародним стандартом для фактору VIII в плазмі крові).
Одна Міжнародна Одиниця (МО) активності фактору VIII еквівалентна такій кількості фактору VIII в одному мл нормальної людської плазми крові. Розрахунок необхідної дози фактору VIII базується на емпіричному результаті, що 1 Міжнародна Одиниця (МО) фактору VIII на кг маси тіла підвищує активність фактору VIII в плазмі крові на 2,1 ± 0,4% від нормальної активності. Потрібна доза визначається за наступною формулою:
Необхідна доза фактору FVIII (МО) = маса тіла (кг) ´ бажаний рівень підвищення фактору VIII (%) (МО/дл) ´ 0,5
Об’єм лікарського засобу, який необхідно ввести, і частота введення завжди повинні бути націлені на клінічну ефективність у кожному окремому випадку.
У випадку виникнення нижченаведених епізодів кровотеч, активність фактору VIII не повинна бути нижче визначеного за відповідний період рівня активності в плазмі крові (у % від нормальної активності або МО/дл). Таблицю нижче можна використовувати для визначення дози при кровотечі або хірургічному втручанні:
|
Ступінь тяжкості кровотечі/ Вид хірургічної процедури |
Необхідний рівень фактору VIII (%) (МО/дл) |
Частота введення доз лікарського засобу (години)/ Тривалість лікування (дні) |
|
Кровотеча |
||
|
Ранній гемартроз, м’язова кровотеча або кровотеча з рота
|
20 ‑ 40 |
Повторне введення кожні 12-24 години щонайменше протягом доби до припинення кровотечі (на підставі больового синдрому) або загоєння
|
|
Більш значний гемартроз, м’язова кровотеча або гематома
|
30 ‑ 60 |
Повторні введення кожні 12‑24 години протягом 3‑4 днів або більше до зникнення больових відчуттів або відновлення працездатності
|
|
Кровотеча, що становить загрозу для життя
|
60 ‑ 100 |
Повторні введення кожні 8-24 години до зникнення загрозливого стану |
|
Хірургічні втручання |
||
|
Малі хірургічні втручання включаючи екстракцію зуба |
30 ‑ 60 |
Кожні 24 години щонайменше протягом доби до загоєння
|
|
Великі хірургічні втручання |
80 ‑ 100 (до- та післяопераційний період) |
Повторні введення кожні 8‑24 години до загоєння рани, потім лікування продовжують щонайменш протягом 7 днів для підтримки активності фактору VIII в діапазоні від 30% до 60% (МО/дл)
|
Протягом курсу лікування з метою визначення необхідної дози лікарського засобу і частоти повторних інфузій рекомендується належним чином визначати рівні фактору VIII у плазмі крові. Зокрема, при великих хірургічних втручаннях необхідно ретельно спостерігати за замісною терапією шляхом аналізу крові на згортання (активність фактору VIII в плазмі крові). У окремих пацієнтів відповідь на терапію фактором VIII може відрізнятися, при цьому в них досягаються різні показники відновлення активності лікарського засобу in vivo і спостерігається різна тривалість напівперіоду.
Для тривалої профілактики кровотечі у пацієнтів з тяжкою гемофілією A, звичайні дози лікарського засобу складають 20 - 40 МО фактору VIII на
За пацієнтами слід спостерігати на предмет утворення інгібіторів фактору VIII. Якщо не вдалося досягти очікуваного рівня активності фактору VIII в плазмі крові або у разі відсутності контролю над кровотечею на фоні застосування лікарського засобу у рекомендованих дозах, слід провести аналіз для визначення інгібіторів фактору VIII. У пацієнтів з високою концентрацією інгібіторів, лікування фактором VIII може бути неефективним і в цьому випадку слід розглянути застосування інших методів лікування. Лікування цих пацієнтів слід проводити під наглядом лікарів, які мають досвід лікування гемофілії.
Хвороба Віллебранда
Загалом, 1 МО фактору фон Віллебранда (vWF:RCo) на
Зазвичай для досягнення гемостазу рекомендується 40-80 МО фактору фон Віллебранда (vWF:RCo) на
Може вимагатися початкова доза 80 МО фактору фон Віллебранда на
Відповідну дозу слід повторно вводити кожні 12-24 годин. Доза і тривалість лікування залежать від клінічного стану пацієнта, типу і тяжкості кровотечі і від рівнів vWF:RCo і FVIII:C.
При використанні препарату фактору фон Віллебранда з вмістом фактору FVIII лікар має знати, що тривале лікування може призвести до значного підвищення рівня фактору FVIII:C. Після 24-48 годин лікування слід розглянути можливість введення менших доз та/або збільшення інтервалу між введеннями доз або використання препарату фактору vWF з низьким вмістом фактору FVIII.
Спосіб введення:
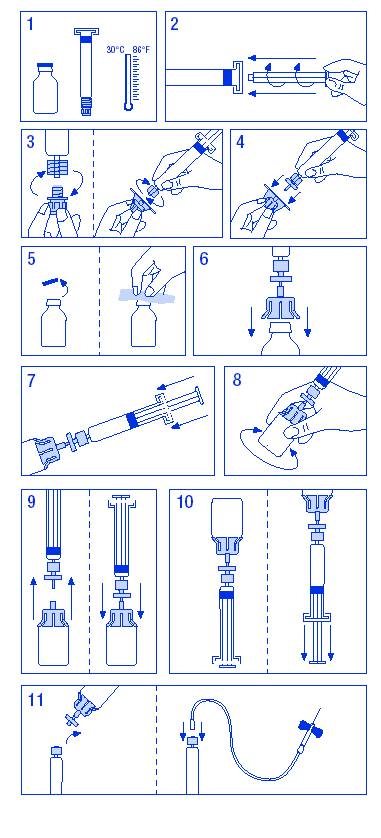
Приготування розчину:
1. Нагрійте флакон і шприц до температури не вище 30ºC.
2. Вставте поршень у шприц з розчинником.
3. Зніміть упаковку з фільтру. Зніміть ковпачок з канюлі шприца і вставте шприц у фільтр.
4. Зніміть упаковку з адаптера до флакона і вставте його у шприц і в фільтр.
5. Зніміть ковпачок із флакона і обробіть пробку наданими тампонами.
6. Проколіть пробку флакона голкою адаптера.
7. Перенесіть увесь розчинник зі шприца у флакон.
8. Злегка струсіть флакон до повного розчинення. Так само, як і у випадку з іншими розчинами для парентерального введення, не використовуйте лікарський засіб, якщо він належним чином не розчинився або є видимі частинки.
9. Швидко від’єднайте шприц/фільтр від флакона/адаптера, щоб видалити повітря.
10. Переверніть флакон і наберіть розчин у шприц.
11. Підготуйте місце для ін’єкції, відокремте шприц і введіть лікарський засіб за допомогою „голки-метелика”.
Лікарський засіб Фанди® слід вводити внутрішньовенно зі швидкістю 3 мл/хв і не більш ніж 10 мл/хв, щоб уникнути вазомоторних реакцій.
Не використовуйте повторно набори для внутрішньовенного введення.
Будь-який невикористаний лікарський засіб або відходи після його застосування повинні підлягати утилізації згідно місцевих вимог.
Розчин має бути прозорим або злегка опалесцюючим. Не використовуйте розчин, якщо він є непрозорий або має осад.
Перед введенням відновлений лікарський засіб необхідно перевірити візуально на наявність твердих часток та зміни кольору.
Не використовуйте після закінчення терміну придатності, зазначеного на упаковці.
Невикористаний лікарський засіб забороняється тримати для подальшого застосування або зберігати у холодильнику.
Діти
Даних клінічних випробувань недостатньо для того, щоб рекомендувати лікарський засіб Фанди® дітям молодше 6 років, як визнаний до застосування.
Передозування.
Не повідомлялося про випадки передозування комплексом факторів FVIII/vWF. Тромботичні події можуть виникнути у випадку значного передозування.
Побічні реакції
У пацієнтів, які отримували лікарські засоби, що містять фактор VIII, рідко спостерігалися гіперчутливість або алергічні реакції (включаючи ангіоневротичний набряк, відчуття жару в місці ін’єкції, озноб, почервоніння, генералізовану кропивницю, головний біль, алергічний висип, підвищення тиску, сонливість, нудоту, занепокоєння, тахікардію, ускладнене дихання, відчуття поколювання, блювоту, свистяче дихання) і в деяких випадках вони переходили в тяжку анафілактичну реакцію (включаючи шок).
У поодиноких випадках спостерігалася лихоманка.
У пацієнтів з гемофілією A можуть утворюватися антитіла, які нейтралізують фактор VIII. У випадку їх утворення стан проявиться як недостатня клінічна відповідь. В цих випадках рекомендується звернутися до спеціалізованого центру з лікування гемофілії.
У пацієнтів із хворобою Віллебранда, зокрема 3-го типу, антитіла (інгібітори), які нейтралізують фактор фон Віллебранда, утворюються рідко. У випадку їх утворення стан проявиться як недостатня клінічна відповідь. Ці антитіла можуть утворитися в тісній взаємодії з анафілактичними реакціями. Тому пацієнти, які мали у минулому анафілактичну реакцію, повинні бути оцінені на наявність інгібітора. В цих випадках рекомендується звернутися до спеціалізованого центру з лікування гемофілії.
У пацієнтів із хворобою Віллебранда, які отримували цей лікарський засіб, є ризик виникнення тромботичних подій, зокрема, у пацієнтів з відомими клінічними або лабораторними факторами ризику.
У пацієнтів, які отримували препарати фактору фон Віллебранда з вмістом фактору VIII, тривалий підвищений рівень фактору FVIII:C в плазмі крові може збільшити ризик виникнення тромботичних подій.
Інфомацію про безпеку щодо трансмісивних агентів див. у розділі «Особливості застосування».
Термін придатності.
3 роки за умови зберігання при температурі не вище 30 ºC.
Після відновлення лікарський засіб є фізично і хімічно стабільним протягом 12 годин при температурі 25 ºC. З мікробіологічної точки зору лікарський засіб слід використати негайно. У протилежному випадку користувач відповідає за термін та умови зберігання готового лікарського засобу до його використання, який, зазвичай, можна зберігати не більш ніж 24 години при температурі від 2 ºC до 8 ºC, за винятком випадків, коли відновлення лікарського засобу не було проведено в контрольованих і перевірених асептичних умовах.
Умови зберігання.
Зберігати при температурі не вище 30 ºC. Не заморожувати. Зберігати в місці, недоступному для дітей.
Див. умови зберігання відновленого лікарського засобу у розділі «Термін придатності».
Несумісність
Лікарський засіб Фанди® не слід змішувати з іншими лікарськими засобами.
Слід використовувати лише наданий набір для введення, оскільки лікування може стати неефективним внаслідок всмоктування комплексу факторів FVIII/vWF внутрішньою поверхнею інфузійного обладнання.
Упаковка
Скляні флакони, в яких міститься 250, 500, 1000 або 1500 МО фактору VIII коагуляції крові людини та 300, 600, 1200 або 1800 МО фактору фон Віллебранда (ліофілізованого), і скляні попередньо наповнені шприци, в яких міститься 10 мл води для ін’єкцій (розчинника) для форм випуску 250, 500 і 1000 МО або 15 мл води для ін’єкцій (розчинника) для форм випуску 1500 МО.
Набір для введення, що постачається разом з Фанди® для відновлення і введення лікарського засобу: адаптер до флакону, фільтр, 2 тампони, просочені спиртом, і „голка-метелик”.
Вміст упаковки: 1 флакон з порошком, 1 попередньо наповнений шприц з розчинником та набір для введення.
Категорія відпуску
За рецептом.
Виробник
Інституто Гріфолс, С.А.
Місцезнаходження виробника та його адреса місця провадження діяльності
С/Кан Гуаш 2, Полігоно Індустріал Леванте, 08150 Паретс дель Вальєс, Барселона – Іспанія.




