Менопур
Склад.
Менопур 600 МО:
діюча речовина: менотропін високоочищений;
1 флакон з порошком містить менотропін високоочищений (людський менопаузний гонадотропін високоочищений, лМГ) у кількості, що відповідає 600 МО ФСГ (фолікулостимулюючий гормон) та 600 МО ЛГ (лютеїнізуючий гормон).
Менопур 1200 МО:
діюча речовина: менотропін високоочищений;
1 флакон з порошком містить менотропін високоочищений (людський менопаузний гонадотропін високоочищений, лМГ) у кількості, що відповідає 1200 МО ФСГ (фолікулостимулюючий гормон) та 1200 МО ЛГ (лютеїнізуючий гормон);
допоміжні речовини: лактоза, моногідрат; натрію гідрофосфат, гептагідрат; полісорбат 20;
1 М розчин кислоти фосфорної;
1 шприц з розчинником містить: м-крезол, вода для ін’єкцій.
Лікарська форма
Порошок ліофілізований для розчину для ін’єкцій.Основні фізико-хімічні властивості:
порошок: білий або майже білий ліофілізат у вигляді коржа;
розчинник: прозорий, безбарвний розчин.
Фармакотерапевтична група
Гонадотропіни та інші стимулятори овуляції. Людський менопаузний гонадотропін. Код АТХ G03G A02.Фармакологічні властивості
Фармакодинаміка.
У препараті Менопур присутній людський хоріонічний гонадотропін (лХГ) – природний гормон, що міститься у сечі постменопаузних жінок, який переважно забезпечує активність ЛГ.
Менотропін, що має активність ФСГ та ЛГ, індукує фолікулярний ріст і розвиток, а також гонадну секрецію стероїдів у жінок, які не страждають на первинну недостатність яєчників. Спочатку ФСГ запускає відновлення фолікулярного росту на стадії раннього фолікулогенезу, тоді як ЛГ є важливим для оваріального стероїдогенезу та бере участь у фізіологічних процесах, що призводять до розвитку відповідного передовуляторного фолікула. Фолікулярний ріст можна стимулювати ФСГ при повній відсутності ЛГ, але отримані фолікули розвиваються аномально. Крім того, така стимуляція супроводжується низькими рівнями естрадіолу, що призводить до недостатньої лютеїнізації.
Узгоджуючись із дією ЛГ, спрямованою на підвищення стероїдогенезу, в циклах IVF/ICSI з десенсибілізацією, рівні естрадіолу при лікуванні Менопуром є вищими, ніж при застосуванні рекомбінантних препаратів ФСГ. Це слід враховувати, якщо контроль реакції пацієнток проводять шляхом визначення рівнів естрадіолу. Відмінностей у досягнутих рівнях естрадіолу не було встановлено при використанні низькодозових протоколів індукції овуляції у пацієнток з ановуляцією.
Фармакокінетика.
Був досліджений фармакокінетичний профіль ФСГ препарату Менопур. Після 7-денного введення 150 МО Менопуру здоровим жінкам-добровольцям із десенсибілізованим гіпофізом максимальні плазмові концентрації ФСГ (відкориговані відповідно до базових) (середнє ± СО) для підшкірного та внутрішньом’язового введення становили 8,9 ± 3,5 МО/л і 8,9 ± 3,5 МО/л відповідно. Максимальні концентрації ФСГ досягаються протягом 7 годин для обох шляхів введення. Після повторного введення період напіввиведення ФСГ становить 30 ± 11 годин і 27 ± 9 годин для підшкірного та внутрішньом’язового введення відповідно (середнє ± СО). Хоча індивідуальні концентрації ЛГ залежно від часу зростають після введення Менопуру, наявних даних недостатньо для проведення фармакокінетичного аналізу.
Менотропін виводиться, перш за все, нирками.
Фармакокінетика Менопуру у пацієнток з порушенням ниркової або печінкової функції не вивчалася.
Клінічні характеристики
Показання
Лікування безпліддя за наявності таких клінічних показань:
· ановуляція, включаючи синдром полікістозних яєчників (СПКЯ), у жінок, які виявилися нечутливими до лікування кломіфену цитратом;
· контрольована оваріальна гіперстимуляція з метою індукції розвитку множинних фолікулів у рамках проведення допоміжних репродуктивних технологій (ДРТ) (наприклад запліднення invitro/перенесення ембріона (IVF/ET), трансфер гамети у фаллопієву трубу (GIFT) та внутрішньоцитоплазматичне введення сперми (ICSI);
· стимуляція фолікулярного росту у жінок з гіпогонадотропним гіпогонадизмом.
Протипоказання
Менопур протипоказаний жінкам:- з гіперчутливістю до діючої речовини або до будь-якої з допоміжних речовин препарату;
- з пухлинами гіпофіза або гіпоталамуса;
- з карциномою яєчників, матки або молочних залоз;
- з гінекологічними кровотечами невстановленої етіології;
- з передчасною менопаузою;
- з кістами яєчників або зі збільшеними яєчниками, що не пов’язано із синдромом полікістозних яєчників (СПКЯ);
- у період вагітності або годування груддю.
Менопур не слід призначати у випадках, коли малоймовірно, що результат лікування буде сприятливим:
- при первинній недостатності яєчників;
- при вроджених вадах розвитку статевих органів, несумісних з вагітністю;
- при фіброїдних пухлинах матки, несумісних з вагітністю.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Медикаментозна взаємодія Менопуру у людини не вивчалася. Навіть за відсутності клінічного досвіду очікується, що одночасне застосування Менопуру та кломіфену цитрату може посилити фолікулярну реакцію. При застосуванні агоністів ГнРГ для десенсибілізації гіпофіза для досягнення належної фолікулярної реакції можуть бути потрібні вищі дози Менопуру.
Особливості застосування
Оскільки Менопур має сильну гонадотропну активність, яка може спричинити побічні ефекти від легкого до середнього ступеня тяжкості, препарат слід застосовувати під контролем лікарів, які спеціалізуються на лікуванні безпліддя та мають досвід такого лікування.Лікування гонадотропінами потребує ретельного медичного нагляду, а також регулярного моніторингу реакції яєчників, а саме: ультразвукових обстежень, можливо, у поєднанні з визначенням сироваткових рівнів естрадіолу. Реакція на введення менотропіну у пацієнток суттєво відрізняється, причому деякі з них дуже слабко реагують на лікування. Слід застосовувати найнижчу ефективну дозу препарату, що відповідає меті лікування.
Першу ін’єкцію Менопуру слід проводити під безпосереднім наглядом лікаря.
До початку лікування слід підтвердити у подружжя діагноз безпліддя та встановити можливі протипоказання щодо вагітності. Зокрема, пацієнток слід обстежити на наявність гіпотиреозу, недостатності кори надниркових залоз, гіперпролактинемії та пухлин гіпофіза або гіпоталамуса, після чого у разі потреби призначити їм відповідне лікування.
У пацієнток, яким у рамках лікування ановулярного безпліддя або проведення ДРТ проводять стимуляцію фолікулярного росту, можливе збільшення яєчників або їхня гіперстимуляція. Такі випадки можна мінімізувати, суворо дотримуючись рекомендованого дозування та режиму введення препарату, а також здійснюючи ретельний моніторинг терапії.
Точну оцінку фолікулярного розвитку і дозрівання повинен проводити лікар, який має досвід інтерпретації відповідних тестів.
Синдром гіперстимуляції яєчників (СГСЯ).
СГСЯ являє собою клінічне явище, яке відрізняється від неускладненого збільшення яєчників. СГСЯ – це синдром, що проявляється зі зростанням ступеня тяжкості. Ознаки СГСЯ включають збільшення яєчників, високі сироваткові рівні статевих гормонів і збільшення проникності судин, яке може призводити до накопичення рідини у перитонеальній, плевральній та у поодиноких випадках – у перикардіальній порожнинах.
Тяжкі випадки СГСЯ можуть супроводжуватися такими симптомами: абдомінальний біль, абдомінальне розтягнення, надмірне збільшення яєчників, збільшення маси тіла, задишка, олігурія та шлунково-кишкові симптоми, такі як нудота, блювання та діарея. При клінічному обстеженні можуть бути виявлені гіповолемія, згущення крові, порушення балансу електролітів, асцит, гемоперитонеум, плевральний випіт, гідроторакс, гостра дихальна недостатність і тромбоемболія.
Надмірна оваріальна реакція на лікування гонадотропінами рідко призводить до розвитку СГСЯ доти, доки з метою ініціювання овуляції не вводять лХГ. Отже, у разі оваріальної гіперстимуляції не слід вводити лХГ; потрібно порадити пацієнтці утриматися від статевих контактів або використовувати бар’єрні методи контрацепції протягом щонайменше 4 днів. СГСЯ може дуже швидко прогресувати (від 24 годин до декількох днів) та набувати серйозної симптоматики, тому пацієнтка повинна перебувати під медичним контролем протягом щонайменше 2 тижнів після введення лХГ.
Мінімізувати ризик розвитку оваріальної гіперстимуляції та багатоплідної вагітності можна, якщо дотримуватись рекомендованого дозування та режиму введення препарату Менопур, а також ретельно контролювати курс лікування. При проведенні ДРТ ризик розвитку гіперстимуляції можна знизити шляхом аспірації усіх фолікулів перед овуляцією.
СГСЯ може ставати тяжчим і тривалішим у разі настання вагітності. Найчастіше СГСЯ розвивається після завершення гормональної терапії і досягає максимальної частоти приблизно через 7-10 днів після закінчення лікування. Зазвичай СГСЯ минає спонтанно з початком менструації.
У разі тяжкого СГСЯ лікування гонадотропінами слід припинити. Якщо воно все ще триває, пацієнтку необхідно госпіталізувати й розпочати специфічне лікування СГСЯ.
Даний синдром частіше спостерігається у жінок із синдромом полікістозних яєчників.
Багатоплідні вагітності.
У разі багатоплідної вагітності, особливо найвищого порядку, підвищується ризик ускладнень для матері й дитини.
У пацієнток, яким проводять індукцію овуляції із застосуванням гонадотропінів, частота багатоплідних вагітностей вища, ніж у разі природного запліднення. Більшість випадків багатоплідних вагітностей представлена двійнями. Для зменшення ризику багатоплідної вагітності рекомендується проводити ретельний моніторинг оваріальної реакції.
У пацієнток, яким проводять процедури ДРТ, ризик багатоплідних вагітностей головним чином залежить від кількості пересаджених ембріонів, їхньої якості та віку пацієнтки.
До початку лікування пацієнтку слід інформувати про потенційний ризик багатоплідної вагітності.
Переривання вагітності.
Частота випадків переривання вагітності – передчасних пологів і спонтанних абортів – вища у пацієнток, яким стимулюють фолікулярний ріст у рамках проведення процедур ДРТ, ніж у звичайній групі пацієнтів.
Позаматкова вагітність.
У жінок із захворюваннями маткових труб в анамнезі існує ризик позаматкової вагітності незалежно від того, настала вагітність внаслідок спонтанного запліднення чи лікування безпліддя. Повідомлялося, що після проведення IVF частота випадків позаматкової вагітності становить 2 – 5 % порівняно з 1 – 1,5 % випадків для загальної групи пацієнтів.
Новоутворення органів репродуктивної системи.
Повідомлялося про випадки розвитку доброякісних і злоякісних новоутворень яєчників та інших органів репродуктивної системи у жінок, яким для лікування безпліддя застосовували декілька лікарських препаратів. Дотепер не встановлено, чи підвищує лікування із застосуванням гонадотропінів базовий ризик розвитку таких пухлин у безплідних жінок.
Вроджені вади розвитку.
Поширеність вроджених вад розвитку після проведення ДРТ може бути трохи вищою, ніж при спонтанному заплідненні. Вважають, що це є результатом відмінностей характеристик батьків (наприклад вік матері, характеристики сперми) і багатоплідних вагітностей.
Тромбоемболічні ускладнення.
Жінкам із загальновизнаними факторами ризику розвитку тромбоемболічних ускладнень, такими як тромбоемболічна патологія в анамнезі або сімейні випадки цієї патології, тяжкий ступінь ожиріння (індекс маси тіла > 30 кг/м2) або тромбофілія, притаманний підвищений ризик венозної або артеріальної тромбоемболії під час або після завершення лікування із застосуванням гонадотропінів. У таких жінок слід зіставити користь застосування гонадотропінів із можливим ризиком. Проте слід зазначити, що сама вагітність теж є фактором ризику тромбоемболічних ускладнень.
Застосування в період вагітності або годування груддю.
Менопур протипоказаний вагітним жінкам.
Даних щодо застосування менотропіну вагітним жінкам немає або вони обмежені. Дослідження на тваринах щодо дії Менопуру під час вагітності не проводились.
Менопур протипоказаний жінкам, які годують груддю.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Відповідні дослідження не проводилися. Однак малоймовірно, що Менопур може впливати на здатність пацієнток керувати автомобілем або виконувати роботу, що потребує підвищеної уваги та швидкої реакції.
Спосіб застосування та дози
Лікування із застосуванням Менопуру слід починати під наглядом лікаря, який має досвід лікування безпліддя.
Менопур 600 МО і Менопур 1200 МО призначений для підшкірної ін’єкції після відновлення розчинником, оскільки шприц, що міститься в упаковці, призначений лише для підшкірного введення.
Порошок необхідно розчинити перед застосуванням. Приготовлений розчин призначений для багаторазового застосування і може зберігатися протягом 28 днів.
При розчиненні слід уникати інтенсивного струшування. Розчин не можна використовувати, якщо він непрозорий або містить частинки.
Режими дозування, описані нижче, аналогічні як при підшкірному, так і при внутрішньом’язовому введеннях. Менопур 600 МО і Менопур 1200 МО можна вводити лише підшкірно, оскільки шприц, що міститься в упаковці, призначений лише для підшкірного введення.
Реакція яєчників на введення екзогенних гонадотропінів є індивідуальною. Це призводить до того, що неможливо встановити одну універсальну схему дозування. Отже, дозування препарату слід підбирати індивідуально, згідно з оваріальною відповіддю. Менопур можна застосовувати у вигляді монотерапії або у складі комбінованої терапії сумісно з агоністом або антагоністом гонадотропін-рилізинг-гормону (Гн-РГ). Рекомендовані дози та тривалість лікування залежать від застосовуваного протоколу лікування.
Жінки з ановуляцією (включаючи СПКЯ).
Метою терапії із застосуванням Менопуру є розвиток одного граафова фолікула, з якого після введення людського хоріонічного гонадотропіну (лХГ) вивільняється ооцит.
Терапію із застосуванням Менопуру слід починати протягом перших 7 днів менструального циклу. Рекомендована щоденна початкова доза Менопуру становить від 75 до 150 МО, яку слід підтримувати щонайменше протягом 7 днів. Подальший режим лікування слід підбирати індивідуально, відповідно до реакції яєчників та на підставі результатів клінічного контролю (який включає ультразвукові дослідження, можливо, у поєднанні з визначенням рівнів естрадіолу).
Дозу препарату не слід змінювати частіше ніж через 7 днів. Рекомендоване покрокове збільшення дози становить 37,5 МО, при цьому воно не повинно перевищувати 75 МО. Максимальна добова доза препарату не повинна перевищувати 225 МО. У разі неналежної реакції пацієнтки після 4 тижнів лікування терапевтичний цикл слід припинити і розпочати новий цикл з вищої дози препарату, порівняно з тією, яка застосовувалась у попередньому циклі.
При досягненні оптимальної реакції через 1 день після останньої ін’єкції Менопуру слід зробити разову ін’єкцію лХГ у дозі від 5000 до 10000 МО.
Пацієнтці рекомендується мати статевий контакт у день введення лХГ і наступного дня.
Альтернативно може бути проведене внутрішньоматкове запліднення (IUI). Якщо спостерігається надмірна реакція на застосування Менопуру, курс лікування слід припинити та відмінити введення лХГ (див. розділ «Особливості застосування»). Пацієнтка повинна використовувати бар’єрний метод контрацепції або відмовитися від статевих контактів до початку наступної менструальної кровотечі.
Жінки, у яких проводять контрольовану оваріальну гіперстимуляцію з метою індукції розвитку множинних фолікулів у рамках проведення допоміжних репродуктивних технологій (ДРТ).
Згідно з результатами клінічних випробувань застосування Менопуру, що передбачає десенсибілізацію із застосуванням агоніста ГнРГ, терапію Менопуром слід починати приблизно через 2 тижні після початку лікування агоністом. Протягом щонайменше 5 перших днів лікування рекомендується вводити Менопур у добовій дозі від 150 до 225 МО.
Відповідно до результатів клінічного контролю (що включає ультразвукові дослідження, можливо, у поєднанні з визначенням рівнів естрадіолу), в подальшому дозу слід підбирати індивідуально, відповідно до реакції пацієнтки, при цьому крок збільшення дози не повинен перевищувати 150 МО. Максимальна добова доза препарату не повинна перевищувати 450 МО. У більшості випадків не рекомендується продовжувати лікування більше 20 днів.
При використанні протоколів, які не передбачають десенсибілізації із застосуванням агоністів ГнРГ, терапію із застосуванням Менопуру слід починати на 2-й або 3-й день менструального циклу. Рекомендується використати такі ж дозування і схему введення, що й для протоколів, які передбачають десенсибілізацію із застосуванням агоністів ГнРГ.
При утворенні достатньої кількості фолікулів відповідного розміру для індукції кінцевого дозрівання фолікулів слід зробити разову ін’єкцію лХГ у дозі до 10000 МО.
Пацієнтка повинна перебувати під ретельним медичним спостереженням протягом не менше 2 тижнів після введення лХГ. Якщо спостерігається надмірна реакція на застосування Менопуру, курс лікування слід припинити та відмінити введення лХГ (див. розділ «Особливості застосування»). Пацієнтка повинна використовувати бар’єрний метод контрацепції або відмовитися від статевих контактів до початку наступної менструальної кровотечі.
Приготування розчину Менопур 600 МО та 1200 МО.
Якщо Ваша клініка попросила Вас робити ін'єкції Менопуру самостійно, Вам слід дотримуватися всіх наданих нею інструкцій.
Перша ін'єкція Менопуру має бути зроблена під наглядом лікаря або медсестри.
Менопур випускається у вигляді порошку у флаконі, перед ін'єкцією його слід розчинити за допомогою одного шприца, наповненого розчинником. Розчинник, який Вам слід застосовувати для розчинення Менопуру, міститься у попередньо наповненому шприці в упаковці.
Менопур 600 МО перед застосуванням слід розчинити за допомогою одного попередньо заповненого шприца з розчинником.
Після розчинення порошку за допомогою розчинника цей флакон містить лікарський засіб у кількості, достатній для кількох днів терапії, тож Вам слід переконатися, що Ви набираєте лікарський засіб у кількості, що не перевищує призначену Вашим лікарем.
Ваш лікар призначив Вам дозу Менопуру у МО (одиницях). Для отримання необхідної дози Вам слід використовувати один із 9 наданих шприців для введення, градуйованих у МО (одиницях) ФСГ/ЛГ.
|
|
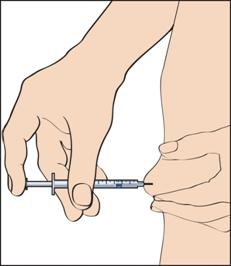
11. Щоб зробити ін'єкцію, слід защипнути шкіру так, щоб утворилася складка, та ввести голку одним швидким рухом під кутом 90 градусів до тіла. Обережно натиснути на поршень, щоб увести розчин (рисунок 11), після чого вийняти шприц для введення.
Вийнявши шприц для введення, натиснути на місце ін'єкції, щоб зупинити кровотечу. Обережний масаж місця ін'єкції сприятиме розповсюдженню розчину під шкірою.
Не слід викидати використані предмети у звичайний домашній смітник; їх слід належним чином утилізувати.
12. Щоб зробити наступну ін'єкцію вже розведеного розчину Менопур, слід повторити кроки 8-11.
Якщо Ви прийняли Менопур у кількості, більшій, ніж потрібно,
будь ласка, повідомте про це медсестру або лікаря.
Якщо Ви забули прийняти Менопур,
не приймайте подвійну дозу, щоб компенсувати пропущену. Будь ласка, повідомте медсестру або лікаря.
Загальні вказівки
Приготовлений розчин не слід вводити, якщо він містить частинки або є непрозорим.
Будь-який невикористаний протягом встановленого терміну придатності препарат або його відходи слід утилізувати відповідно до місцевих вимог.
Діти
Препарат не застосовують дітям.
Передозування
Прояви передозування препарату невідомі, хоча можна очікувати розвиток синдрому гіперстимуляції яєчників.
Побічні реакції
У клінічних випробуваннях Менопуру найчастіше повідомлялося про такі побічні реакції: абдомінальний біль, головний біль, реакції та біль у місці введення препарату, частота яких досягала 5 %.
Нижче перелічені основні побічні реакції у жінок, яким застосовували Менопур у клінічних випробуваннях.
Побічні реакції розподілено за частотою таким чином: дуже часті (≥ 1/10), часті (від ≥ 1/100 до
Порушення з боку органів зору: частота невідома – порушення зоруa.
Порушення з боку шлунково-кишкового тракту: часті – абдомінальний біль, здуття живота, нудота; нечасті – блювання, абдомінальний дискомфорт, діарея.
Загальні порушення і порушення у місці введення: часті – реакції у місці ін’єкціїb; нечасті – слабкість; частота невідома – пірексія, нездужання.
Порушення з боку імунної системи: частота невідома – реакції гіперчутливостіс.
Дослідження: частота невідома – збільшення маси тіла.
Порушення з боку скелетно-м'язової та сполучної тканини: частота невідома – м’язово-скелетний більd.
Порушення з боку нервової системи: часті – головний біль; нечасті – запаморочення.
Порушення з боку статевих органів та молочних залоз: часті – СГСЯe, біль у ділянці тазаf; нечасті – кіста яєчників, скарги на біль в грудяхg; частота невідома – перекрут яєчникаe.
Порушення з боку шкіри та підшкірних тканин: поодинокі – акне, висип; частота невідома – свербіж, кропив’янка.
Порушення з боку серцево-судинної системи: нечасті – припливи; частота невідома – тромбоемболіяe.
aОкремі випадки тимчасового амаврозу, диплопії, мідріазу, скотоми, фотопсії, плаваючі помутніння склистого тіла, помутніння зору і розлади зору були зареєстровані як порушення зору під час постмаркетингового періоду.
b Найбільш часто повідомлялося про реакції в місці ін’єкції, а саме біль у місці ін’єкції.
c Є повідомлення про поодинокі випадки локалізованих або генералізованих алергічних реакцій, включаючи анафілактичні реакції, поряд з відповідною симптоматикою.
d М’язово-скелетний біль включає артралгію, біль у спині, біль у шиї і біль у кінцівках.
e При застосуванні Менопуру в клінічних випробуваннях повідомлялося про розвиток шлунково-кишкових симптомів, пов’язаних з СГСЯ, таких як здуття живота, відчуття дискомфорту, нудота, блювання та діарея. Випадки тяжкого асциту, пов’язаного з СГСЯ і накопичення рідини у тазу, плевриту, задишки, олігурії, тромбоемболічних явищ і перекручення яєчників були представлені як рідкі ускладнення.
fТазові проблеми включають біль у яєчниках і опущення матки.
gСкарги щодо грудних залоз включають біль у грудях, болючість молочних залоз, дискомфорт, біль у сосках і набухання грудей.
Термін придатності
3 роки.Після приготування розчин можна зберігати протягом щонайбільше 28 днів при температурі не вище 25 °С.
Умови зберігання
Зберігати в недоступному для дітей місці. Зберігати в холодильнику(2–8 °С) в оригінальній упаковці. Не заморожувати.
Несумісність
Приготовлений розчин препарату Менопур не слід змішувати з іншими лікарськими засобами, за винятком препарату урофолітропіну Бравель (ФСГ) виробництва компанії Феррінг. Дослідження продемонстрували, що сумісне введення препаратів Бравель і Менопур істотно не впливає на очікувану біодоступність кожного з них.Упаковка
Менопур 600 МО.
1 флакон з порошком у комплекті з1 попередньо заповненим шприцом з розчинником по 1 мл, 1 голкою для розведення, 9 шприцами для введення та 9 спиртовими серветками в картонній упаковці.
Менопур 1200 МО.
1 флакон з порошком у комплекті з 2 попередньо заповненими шприцами з розчинником по 1 мл, 1 голкою для розведення, 18 шприцами для введення та 18 спиртовими серветками в картонній упаковці.
Категорія відпуску
За рецептом.Виробник
Феррінг ГмбХ, Німеччина/Ferring GmbH, Germany.
Місцезнаходження виробника та його адреса місця провадження діяльності
Вітланд 11, 24109 Кіль, Німеччина/Wittland 11, 24109 Kiel, Germany.